Die coolsten Proteine der Welt: Anti-Frost-Proteine
BLOG: Die Sankore Schriften

Winter is coming und deshalb ziehe ich manchmal an jedem Fuß zwei Strümpfe übereinander an um gegen den Frost gewappnet zu sein. Verständlich, dass ich Tiere beneide, die an Frost sehr gut angepasst sind, sei es durch einen Pelz oder Anti-Frost-Proteine. Diese sind, obwohl ihre Entdeckungsgeschichte und ihr Wirkmechanismus ziemlich spannend sind, weit weniger bekannt als die Keratine (eine Klasse von Proteinen) im Pelz oder die Hitzeschockproteine.
Warum ist das Einfrieren der Körperflüssigkeiten so lebensgefährlich für Organismen?
Das Zytoplasma tierischer Zellen hat einen Wasseranteil von 80 bis 85 Prozent, wobei das meiste Wasser in Hydrathüllen gebunden ist. Bei Frost quetschen wachsende Eiskristalle im Zytoplasma die Zellen von innen und beschädigen das Zytoskelett ebenso wie intrazelluläre Membransysteme und den Zellkern. Zusätzlich kommt es beim Wasserentzug durch Kristallisation zu diversen schädlichen Effekten, die als „solution effects“ zusammengefasst werden.
Durch die Erhöhung der Osmolarität und der Ionenkonzentration kommt es zur Denaturierung von Proteinen. In der analytischen Biochemie ist dieser Effekt als „aussalzen“ von Proteinen bekannt und wird zur deren Aufreinigung eingesetzt. Mit dem weiteren Verlust des Wassers durch Kristallisation schwindet die Hydrathülle von Makromolekülen und der Membran. Die Hydrathülle spielt beim Erhalt der dreidimensionalen Struktur von Proteinen, und damit ihrer biochemischen Funktion, eine wichtige Rolle.
Biologische Membranen besitzen einen Wasseranteil von etwa 10%, wobei Wassermoleküle sowohl in der hydrophilen Kopfregion als auch im lipophilen Teil der Lipide zu finden sind, wo sie als Platzhalter („Spacer“) fungieren. Wird dieses Wasser entzogen, lagern sich die Kohlenwasserstoffketten aufgrund der hydrophoben Wechselwirkungen (Van-der-Waals-Kräfte) dichter zusammen. Durch den festeren Zusammenhalt erhöht sich der Schmelzpunkt der Membran. Das heißt, die Membran geht vom Flüssigkristall- in den Gelzustand über. Im Gelzustand ist die Membran wesentlich weniger flexibel und bricht vor allem an der Kontaktzone zwischen Lipiden und Membranproteinen.
Die Entdeckung der Anti-Frost-Proteine
Die Suche nach Anti-Frost-Proteinen begann in den 1950er mit den Arbeiten des schwedisch-norwegischen Tierphysiologen Per Fredrik Thorkelsson Scholander: Der untersuchte, warum arktische Fische in Wasser überleben können, das Temperaturen aufweist, die unter dem Gefrierpunkt ihres eigenen Blutes liegen. Bei Temperaturen von minus 1,8° C müsste eigentlich jeder Fisch erstarren. Der Grund: Der Gefrierpunkt für Fischblut liegt bei ungefähr minus 0,9° C. Seine Experimente veranlassten ihn zu der Annahme, dass es ein Antifrostmittel in ihrem Blut geben müsse. Ende der 1960er Jahre konnte der Zoologe Arthur DeVries das erste Anti-Frost-Protein aus antarktischen Fischen isolieren.
Dieses Schutzprotein, das das Einfrieren der Körperflüssigkeiten verhindert und damit das Überleben im Wasser auch bei extrem niedrigen Temperaturen ermöglicht, entstand genau in jener Zeit der Erdgeschichte, in der sich die Antarktis enorm abkühlte und zu einer extrem lebensfeindlichen Umgebung wurde. Unmittelbar nach der Erfindung des Anti-Frost-Proteins begann die Auffächerung der Antarktisfische, der sogenannten Notothenioidei, in eine Vielzahl von Arten [1]. Die Notothenioidei konnten nun eine neue ökologische Nische erobern – die eisigen Gewässer der Antarktis.
Die Diversität von Anti-Frost-Proteinen
Insgesamt kennen die Biologen heute etwa 30 Anti-Frost-Proteine in Bakterien, Pflanzen, Insekten und Fischen. Sie werden in fünf Klassen einteilt, sind meist 35 bis 45 Aminosäuren lang und damit ziemlich kleine Proteine. (Ich habe keine Ahnung, warum man hier nicht von Anti-Frost-Peptiden spricht.)
| Merkmal | AFGP | AFP Typ I | AFP Typ II | AFP Typ III | AFP Typ IV |
| Molekulare Masse (Daltons) | 2,600 – 33,000 | 3,300 – 4,500 | 11,000 – 24,000 | 6,500 | 12,229 |
| Primärstruktur | (Alanin-Alanin- Threonin)n Disaccharid | Alaninreich, viele Kopien von 11xAA-Wiederholungen | Cysteinreich, Disulfidbrücken | generell | 17% Glutamin, keine Disulfidbrücken, generell |
| Kohlenhydrate | Ja | Nein | Nein, (Ausnahme Goldlachs 3% Kohlenhydrate) | Nein | Nein |
| Sekundärstruktur | erweitert | α-Helix, amphiphil | β-Faltblatt | β-Sandwich | α-Helix, amphiphatisch |
| Tertiärstruktur | Nicht bestimmt | 100% Helix | Nicht bestimmt | Nicht bestimmt | Vier Helices antiparallel gebündelt |
| Biosynthese | Multiprotein | Prepro-AFP | Prepro-AFP (?) | Pro-AFP | keine post-translationalen Modifikationen |
| Proteinbestandteile | 8 | 7 | 2-6 | 12 | 1 |
| Genkopien | Nicht bestimmt | 80 – 100 | 15 | 30-150 | Nicht bestimmt |
| Natürliche Herkunft | Antarktische Notothenioidei, Kabeljau, Grönland-Kabeljau | Winterflunder, Süßwassersteinfisch | Seerabe, Goldlachs, Hering | Meeres-Dickkopf, Seewolf | Myoxocephalus octodecemspinosus |
Wie man in der obigen Tabelle sieht, sind Anti-Frost-Proteine völlig unterschiedlich aufgebaut, was ein starkes Indiz für eine konvergente Evolution dieser Proteinklasse ist. Sie können Glykoproteine sein, Disulfidbrücken besitzen oder auch Knäuel ohne besondere Merkmale sein. Gut untersucht und am längsten bekannt sind die Anti-Frost-Proteine von Fischen wie der Winterflunder. Sie bilden eine Helix mit positiv und negativ geladenen Resten, die nach außen zeigen.
Das Gefrieren von wässrigen Lösungen
Um den Wirkmechanismus von Anti-Frost-Proteinen zu verstehen, muss man die drei verschiedenen Phasen des Gefrierens von wässriger Lösung kennen: Unterkühlung, Nukleation und Eiskristallwachstum.
In unterkühlter Lösung liegt die Temperatur unterhalb des Gefrierpunktes es haben sich aber noch keine Eiskristalle gebildet. Der unterkühlte Zustand ist eine metastabile Phase und kann z.B. durch mechanische Erschütterung bereits beendet werden.
Die Entstehung eines Kristallkeims (auch Kristallembryo genannt), die Nukleation, ist der geschwindigkeitsbestimmende Schritt beim Gefrieren. Bei der Nukleation1 bildet sich ein sogenanntes „flickering cluster“, ein Netzwerk von Wassermolekülen, die über Wasserstoffbrückenbindungen miteinander verbunden sind. Damit aus dem flickering cluster ein Kristallgitter entstehen kann, müssen diese Bindungen gelöst werden.
Kristallgitter bilden sich in der unterkühlten flüssigen Phase ständig spontan, aber durch die frei werdende Energie (die Entropie nimmt ab beim Phasenübergang von flüssig zu fest, d.h., die Enthalpie nimmt zu, was zu einer hohen Oberflächenenergie an der Phasengrenze führt) dissoziieren die Kristallkeime genauso schnell wieder. Erst ab einer bestimmten Größe ist ein Kristallkeim stabil und wächst. Die kritische Größe sinkt mit abnehmender Temperatur.
Bei –40°C beträgt die kritische Größe 11,3 Å (Radius) d.h., es sind ca. 190 Wassermoleküle notwendig um die minimale Größe eines stabilen Nukleationskeimes zu bilden. Am Anfang bilden sich wenige kleine Kristallembryonen. Je größer das Wasservolumen, desto wahrscheinlicher bildet sich irgendwo ein Kristallembryo, der groß genug ist, als Kristallisationskeim zu dienen. Das Kristallwachstum2 setzt in unterkühlter Flüssigkeit ein, sobald mindestens ein Kristallkeim entstanden ist. Kristallisationskeime stehlen Wassermoleküle von den Kristallembryonen in ihrer unmittelbaren Umgebung.

Das Eiskristallwachstum nach der Nukleation läuft in drei Schritten ab: Annäherung des Wassermoleküls, Anbindung an den Eiskristall und Abfuhr der Kristallisationswärme. Die Geschwindigkeit des Kristallwachstums wird überwiegend bestimmt durch die mögliche Annäherungsgeschwindigkeit des Wassermoleküls, z.B. durch die Viskosität der Lösung bzw. die Verfügbarkeit von freien Wassermolekülen und die Abfuhr der Kristallisationswärme, z.B. durch Wärmeleitfähigkeit des Kristalls bzw. Flüssigkeit oder der Temperatur.
Die Abfuhr der Kristallisationswärme bedingt die Form des Eiskristalls. Gefrieren z.B. wässrige Lösungen an der Oberfläche, wird die Wärme überwiegend über die Eisphase abgeleitet und an die Umgebungsluft abgegeben. Es entstehen Eiskristalle mit sehr glatter Oberfläche. Kristallisiert Eis in Flüssigkeit oder in Luft (aus Wasserdampf), werden dendritische Formen (Schneeflocken) bevorzugt, da die Austauschfläche an den Spitzen der Dendriten größer ist.
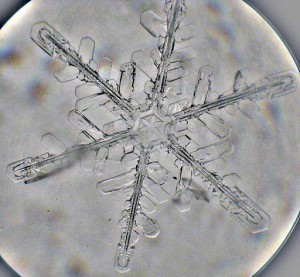
Liegt Wasser nicht in reiner Form vor, sondern enthält gelöste Stoffe, ist das Verhalten bei sinkender Temperatur komplexer. Gelöste Stoffe senken allgemein das chemische Potenzial (μ) von Wasser, was zu einer Erhöhung der Siedetemperatur und Senkung des Gefrierpunktes führt, da bei einer bestimmten Temperatur die Phase mit dem niedrigsten μ am stabilsten ist. Dies ist eine so genannte kolligative Eigenschaft, da die Stoffmenge für das Ausmaß der Temperaturveränderung maßgeblich ist und nicht die Stoffart. Pro Osmol sinkt der Gefrierpunkt von Wasser um 1,86°C. Genutzt wird dieses Phänomen z.B. bei der Salzstreuung im Winter um Eisglätte zu verhindern.
In wässrigen Lösungen findet heterogene Nukleation statt, es liegt ein Nukleationskeim vor, der nicht rein aus Wassermolekülen besteht. Ein heterogener Nukleationskeim besitzt eine molekulare Oberfläche, die in ihrem Muster von Wasserstoffbrückendonoren und -akzeptoren einem Eiskristall ähnelt. Beim Gefrieren wässriger Lösungen kommt es stets zu einer Phasentrennung von Lösungsmittel und gelösten Stoffen. Beim Phasenübergang kristallisiert Wasser und konzentriert die gelösten Stoffe auf. Ab der Löslichkeitsgrenze fallen zunehmend Feststoffe aus, sodass reines Eis und hydratisiertes Salz vorliegen.
Konventionelle künstliche und natürliche Antifrost-Mittel bestehen meist aus kleinen Molekülen, die in hohen Konzentrationen den Gefrierpunkt senken. Der Käfer Upis ceramboides krabbelt durch Alaska und schützt sich durch ein großes Molekül aus dem Vielfachzucker Xylomannan vor dem Erfrieren. Er benutzt damit eines der wenigen Frostschutzmittel im Tierreich, das nicht auf einer Proteinstruktur basiert. Bei großen Molekülen wie Xylomannan genügen dagegen geringe Mengen: Sie binden sich einfach in die Eiskristallgitter ein und verhindern so deren für Zellen gefährliches Wachstum.
Ein weiteres Phänomen, das in wässrigen Lösungen auftritt, ist die sogenannte Vitrifikation (Verglasung), die in Konkurrenz zur Kristallisation auftritt, auf diese werde ich hier aber nicht weiter eingehen.
Anti-Frost-Proteine blockieren das Eiskristallwachstum
Alle Anti-Frost-Proteine wirken auf die gleiche Weise: Sie binden an Eiskristalle und verhindern oder verlangsamen deren Wachstum. Die Dipolmoleküle binden dann an die polare Oberfläche eines entstehenden Eiskristalls. Dadurch wird die weitere Anlagerung von Wassermolekülen blockiert, schließlich hört der Kristall ganz zu wachsen auf. Normalerweise breitet sich ein Eiskristall dreidimensional sehr schnell aus. Sind AFPs anwesend, lässt sich unter dem Mikroskop beobachten, wie sich jetzt statt eines großen Kristalls viele kleine bilden, die eine bipyramidale Form haben. Anti-Frost-Proteine erniedrigen den Gefrierpunkt von Wasser um einige Grad aber überraschenderweise ändern sie nicht den Schmelzpunkt von Eis. Diesen Effekt nennt man thermische Hysterese.
Forscher entdeckten letztes Jahr einen neuen Wirkmechanismus beim Anti-Frost-Protein des Feuerkäfers Dendroides canadensis. Seine Larven überstehen den Winter selbst bei –30°C. Das AFP des Feuerkäfers ist zehn bis hundert Mal aktiver als die AFPs von arktischen und antarktischen Fischen. Die Wissenschaftler extrahierten Anti-Frost-Proteine aus Käferlarven und gaben etwas davon in Wasserproben. Mithilfe eines sogenannten Terahertz-Spektrometers beobachteten sie dann die Wassermoleküle in der unmittelbaren Umgebung des AFPs. Normalerweise trennen und verbinden sich Wassermoleküle durchschnittlich eine Billion Mal pro Sekunde. In unmittelbarer Nähe zu den Frostschutzproteinen verlangsamte sich der Schlagabtausch der Wassermoleküle. Die Verbindungen zwischen den Wassermolekülen öffneten und schlossen sich nun bis zu dreimal langsamer. Je langsamer sich diese Verbindungen öffnen und schließen, desto kälter kann es sein, bevor das Wasser gefriert. Bei einer Wassertemperatur von 20°C würden Wassermoleküle noch in der siebten Lage beeinflusst, schreiben die Wissenschaftler.
Das bedeutet: Wenn Wassermoleküle in mehreren Kreisen um ein Frostschutzprotein herumwirbeln, dann öffneten und schlossen sich die Verbindungen zwischen den Wassermolekülen in den sieben innersten Kreisen langsamer. Das AFP des untersuchten Feuerkäfers ist effizienter als die AFPs von anderen Tieren, weil sich die beiden Mechanismen unterstützen.
Anwendungen in der Industrie
In einigen Ländern werden die AFPs aus Fischen bereits Lebensmitteln zugemischt. Der Konzern Unilever, Hersteller von Magnum-Eis lässt ein entsprechendes Protein von einer gentechnisch veränderten Hefe erzeugen. Speiseeis wird damit noch cremiger, da beim Gefrieren keine groben Eiskristalle entstehen. In den USA, Australien, Neuseeland und mehreren südamerikanischen Ländern ist dieses Eis bereits zugelassen Zuvor eingefrorene Brötchen schrumpfen beim Auftauen und werden schnell trocken. Forscher arbeiten bereits daran, wie man diesen Gefrierbrand verhindern kann.
Gemeinsam wollen Biologen und Lackforscher am Fraunhofer Institut für Fertigungstechnik und Angewandte Materialforschung (IFAM) in Bremen neue Beschichtungen mit eingebautem Anti-Eis-Effekt entwickeln. Damit könnten sie die Tragflächen von Flugzeugen, Windenergieanlagen, Strommasten und -kabeln frostfest machen. Das langwierige Enteisen von Flugzeugen wäre dann nicht mehr nötig. Auch Strommasten würden im Winter nicht unter der Eislast zusammenbrechen und viele Haushalte von der Stromversorgung abschneiden.
Fußnoten
1. Man spricht in dem Fall, wenn ausschließlich Wassermoleküle den Keim bilden, von homogener Nukleation. Die homogene Nukleationstemperatur ist abhängig vom Volumen. Für einen 1μm großen Tropfen beträgt sie -39°C und steigt um 2°C beim Anstieg des Tropfendurchmessers um den Faktor 10 für tierische Zellen wird daher eine homogene Nukleationstemperatur im Bereich von -38°C – -44°C erwartet.
2. Wässrige Lösung kann selbst unter idealen Bedingungen nicht beliebig weit unterkühlt werden. Spätestens an der homogenen Nukleationstemperatur von etwa -40°C (der aktuelle Rekord der Unterkühlung von reinem Wasser liegt bei -42,15°C) ist die minimale Größe so gering (ca. 190 Moleküle), dass sich Wassermoleküle spontan zu einem Nukleationskeim zusammenlagern.
Weiterführende Literatur
Eisfreie Oberflächen durch Anti-Frost-Proteine
Extreme Minusgrade: Frostschutzproteine schützen Feuerkäfer
Frostschutzprotein bildet erweiterte Hydrathülle
Bildnachweis
Bild Eiskristall
Date: 18 June 2006
Source: own drawing, created with Diamond 3.1
Author: Solid State
This file is licensed under the Creative Commons Attribution-Share Alike 3.0 Unported license.
Bild Schneeflocke
Date: 15 January 2009, 08:24
Source: snowflake 20090115_0730
Author: Michael from U.S.A.
This file is licensed under the Creative Commons Attribution-Share Alike 2.0 Generic license.


Die ersten Antifrostproteine wurden also Ende der 1960er Jahre entdeckt/isoliert, aber die Anwendungen der Antifrosttechnologie in er Kryokonservation und den frostunempfindlichen Oberlächen kommen teilweise erst heute. Das passt zu einer erst kürzlich gemachten Beobachtung: Die grossen technischen Durchbrüche, die Zeit in der Innovation auf Steroiden lief ist schon lange vorbei oder wie es in einem Aeon-Artikel zu lesen ist
Doch vielleicht ist diese Diagnose auch zu oberflächlich. Es könnte doch sein, dass die meisten wirklich grossen Entdeckungen zwar schon gemacht wurden, dass aber ihre bedeutsamsten Anwendungen noch auf uns warten. Einfach weil es zuwenig Forscher gibt, die in der Lage sind all die ungeheuren Schätze, die bereits gehoben wurden, in Anwendungen umzusetzen, die unseren Alltag verändern.
Die Anwendung der Antifrosttechnologie ist da wohl nur ein Beispiel unter vielen, was ich mit folgender Liste zeigen will
– DNA: Entdeckung/Strukturauferklärung 1953, erst heute Grundlage der personalisierten Medizin und der Immun-Krebstherapie
– Zivile Nutzung der Nukleartechnologie: Ablösung von Druchwasserreaktoren durch Salzschmelzereaktoren steht bevor, Nuklearfusion steht bevor
– Laser: erster Laser (RubinLaser) 1960, das STED-Mikroskop von David Hell von 2014 benutzt zwei Laser, Laser für die Laserfusion, Laser für die Plasma-Wakefield-Beschleunigung in tabletop-Partikelbeschleunigern erst gerade in den Startlöchern.
Die Liste liesse sich noch beliiebig verlängern. Es ist einfach so: Wirklich grosse Durchbrüche sind selten. Die Anwendungen aber, die unsern Alltag verändernt, die können noch dutzende von Jahren später entwickelt werden.
Toller frostiger Beitrag, Joe!
Frohes Neues, und weiter so!
Pingback:Romeo und Julia: Die tragische Geschichte hinter ICD10-GM-2015: I46.0 › Die Sankore Schriften › SciLogs - Wissenschaftsblogs
Bitte mal Quellenangaben prüfen und angeben!
Ein Großteil des Textes ist übernommen aus der Dissertation von Dipl. Biol. Friederike Ehrhart (Uni Saarland) (S.5-9) bzw. Fletcher (1974) und Hobbs (1974).
http://scidok.sulb.uni-saarland.de/volltexte/2011/3780/pdf/Dissertation_Ehrhart_final.pdf
Ich hab den Fehler korrigiert und die fehlende Quellenangabe eingefügt.