CRISPR, Genome-Engineering und genmanipulierte Embryos: Spiel mit dem Erbgut?
BLOG: 1ife5cience

Da haben also in China Wissenschaftler menschliche Embryonen genetisch verändert. Und zwar einfach weil sie es können. Okay, okay, sie haben versucht, β- Thalassämie, eine Blutkrankheit, zu heilen, indem sie das in dieser Krankheit mutierte Gen verändern wollten. Das hat nicht sooo gut funktioniert. Und außerdem haben sie noch andere Stellen in der DNA mitverändert. Versehentlich.
Die Methode mit der sie gearbeitet haben heißt „CRISPR/Cas“. Und mit eben dieser CRISPR/Cas-Methode habe ich auch gearbeitet.
Was ist CRISPR/Cas?
CRISPR ist eigentlich eine Art erworbene Immunantwort von Bakterien. Bakterien können, wie andere Zellen auch, von Viren infiziert werden (sie heißen dort Phagen). Und wie wir schon gelernt haben sind Viren nichts anderes als Nanomaschinen des Todes – äh – nein, Moment, in erster Linie sind sie einfach Erbgut-Lieferanten. Sie schleusen ihr eigenes Erbgut in andere Zellen ein und übernehmen sie so quasi. Die Zellen überleben das meistens nicht und so ist es gut, wenn ein Lebewesen das eben nur aus einer Zelle besteht, sich dagegen wehren kann. Und genau das ist CRISPR. Es ist ein bakteriellen System welches virale DNA erkennt und eliminiert. Sie merkt sich die fremde DNA indem sie sie in ihrem eigenen Erbgut speichert. So kann sie das Gegenstück (als RNA) produzieren. Wer sich an die Struktur der DNA erinnert, weiß, dass es sich die DNA mit einem Spiegelbild verbinden kann. Wir nennen das rückwärts komplimentär. Aber ich finde Spiegelbild ganz gut. Die gespeicherte virale DNA baut also ein Spiegelbild zu der echten viralen DNA. Und wenn diese virale DNA in die Zelle kommt bindet das Spiegelbild daran. Sogenannte Endonukleasen können DNA „zerstückeln“ und unschädlich machen. Diese molekularen Scheren heißen Cas (und im Falle des Papers ist es Cas9) und sind an das Spiegelbild der viralen DNA gebunden. Sie zerstückeln ganz schnell die fremde DNA. So wird diese unschädlich.
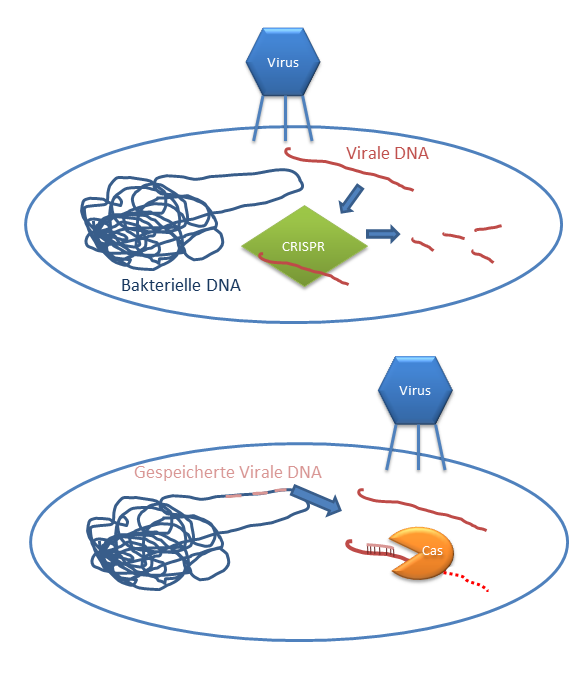
Wie nutzt man CRISPR/Cas bei der Genomeditierung
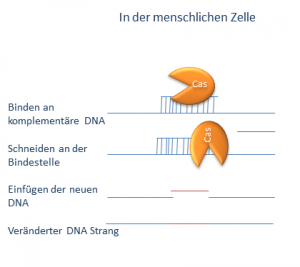
Das spannende an CRISPR ist, dass es eine bestimmte Sequenz im Erbgut erkennt und das Cas hier dann einen Schnitt setzt und den DNA-Strang trennt. In Säugerzellen können solche Schnitte in der DNA (man sagt auch DNA-Bruch), repariert werden. Dabei geschehen oft Fehler. Es wird Information entfernt oder Unsinns-Information eingefügt. Das verändert das Gen an dieser Stelle und kann es auch ganz ausschalten indem es zu einer Unsinnskorrektur kommt. Man kann aber auch eine Korrekturvorlage mitgeben. Die Reperaturwerkzeuge unserer Zellen können nämlich Vorlagen einbauen. So kann man theoretisch einen Teil des genetischen Information nicht nur Löschen sondern auch verändern. Welche Mechanismen es gibt habe ich in dem Schaubild unten aufgeführt. Nach einem Schnitt in der DNA kann erstens einfach mal gar nichts passieren – wenn alles korrekt repariert wird. Oder die Änderung ist sehr geringfügig. Die Information bleibt zum Großteil erhalten und kann sogar noch vollständig sein. Oft wird ein Teil der Information entfernt und ist dann weg. Da die restliche Information immer in Dreierpäckchen gelesen wird, kann die Information verloren gehen. Jetzt kann man der Zelle aber auch eine Vorlage geben die eingebaut wird und die Stelle in der genetischen Information ersetzt.
Was haben die chinesischen Forscher gemacht?
Die Forscher wollten Erbgutinformation verändern, welche defekt war. Sie wollten also ein falsches Gen mit einem richtigen Gen ersetzen und dabei eine kleine Stelle ersetzen. Dazu nahmen sie Embryonen – die nicht überlebensfähig waren – und ersetzten dort Stellen in einem Gen für eine Blutkrankheit. Die Ergebnisse sind nicht berauschend. Nur vier der 28 Embryonen trugen die Veränderung in sich. Dafür wurden diese Veränderungen auch in anderen Genen sichtbar. Nämlich solche, welche dem eigentlichen Ziel sehr ähnlich waren. Wir sprechen von Off-Target-Effects, also „Am-Ziel-Vorbei-Effekten“.
Was haben die Forscher falsch gemacht?
Die CRISPR/Cas-Veränderungen können auch in DNA-Stücken auftreten, die der eigentlichen Ziel-DNA sehr ähnlich ist. Meine erste, rein wissenschaftliche Reaktion war: „Not Shit, Sherlock!“.
Warum? Über die Seiteneffekte von CRISPR/Cas war relativ schnell sehr viel bekannt. Das sogenannte spezifische System ist eben nicht so spezifisch. Mittlerweile gibt es jedoch einige Verbesserungsideen, welche die chinesischen Forscher außer Acht lassen.

So verwenden sie ein Enzym, welches genau einen Schnitt durch nur eine DNA-Stelle macht. Es gibt aber auch ein System, bei dem man nur einen halben Schnitt durch nur zwei verschiedene, nah aneinanderliegende DNA-Stücke macht. Durch die Nähe der beiden Einschnitte entsteht eine Sollbruchstelle. Diese Methode ist spezifischer, da zwei verschiedene Punkte gefunden werden müssen. Bindet man mit diesem System nur an eine Stelle entsteht nämlich keine Sollbruchstelle. Wieso hat man also nicht diese spezifischere Methode benutzt?
Zusätzlich kann man natürlich versuchen Stellen zu nehmen, die möglichst nur einmal im Genom vorkommen. Da ist man natürlich ein wenig eingeschränkt, denn es wurden auch Stellen verändert, die nur ähnlich waren. Die Methode ist also einfach nicht sehr genau.
Die Forscher nehmen zur Probe eine embryonale Zelllinie. Dies sind keine Embryonen, sie sind nur aus (relativ alten) Embryonen entstanden. Es wäre eine gute Idee gewesen, in dieser Zelllinie erstmal Off-Target-Effects zu schauen. Und in der Tat gibt es genug Literatur über Off-Target-Effects.
Im Paper selbst fehlt jeder Hinweis auf eine Methode, wie sie die DNA und die Cas9 in die Embryonen bekommen haben. Sie verweisen dort einfach nur auf ein Methoden-Paper. Das finde ich ziemlich schlampig. Außerdem geht es in diesem Paper um eine andere Form der Cas9. Es ist also nicht klar, was genau denn nun verwendet wurde.
Kommentar und ethische Bedenken
Menschliche Embryonen wurden also einer unausgereiften Methode unterzogen wurden obwohl es bereits ausgereiftere Methoden gibt. Das ist – in meinen Augen – grober Unfug. Ich glaube, menschliche Embryonen zu nehmen sollte nur ein Aufhänger sein, um in einem höheren Journal zu publizieren. Diese haben das Paper aber aus ethischen Gründen abgelehnt. Wirklich nur deshalb? Ich glaube nicht. Weder sind die angewandten Methoden neu noch bieten sich damit neue Ansatzpunkte für weitere Forscher. Ob man nun das Erbgut eines menschlichen oder eines mäuslichen Embryos verändert ist den Zellen und der CRISPR/Cas Methode im Großen und Ganzen egal. Die Forscher begründen es damit, dass die DNA-Reparatur in Embryonen kaum erforscht ist. Aber selbst tun sie es eigentlich in ihrem Paper auch nicht.
Die verwenden Embryonen sind nicht vermehrungsfähig. Das ändert nichts daran, dass sie Embryonen sind und dass das Erbgut darin menschlich ist. Aber warum sind sie nicht vermehrungsfähig? Sie stammen aus künstlichen Befruchtungen. Bei einer künstlichen Befruchtung wird das Erbgut aus dem Sperma des Vaters in die Eizelle der Mutter eingeschleust. Dann sieht man zwei Pronuklei, also zwei vorläufige Zellkerne (eine von der Mutter und einen vom Vater) die später zu einem werden. Da die Technik manuell durchgeführt wird, entstehen aber Fehler. Manchmal können sich aber (zum Beispiel durch die Injektionsnadel) drei Pronuklei bilden. Die drei Pronuklei kann man unter dem Mikroskop erkennen. Diese Zellen haben eine sehr geringe Chance, sich weiter zu entwickeln und gelten daher bei der künstlichen Befruchtung als Ausschuss. Im Gegensatz zur Meinung der chinesischen Autoren entstehen solche tripronuklearen Embryonen übrigens nicht aus Eizellen, die mit zwei Spermien befruchtet werden. Oder nur selten. Sagt zumindest das verlinkte Paper, das neuer ist als das, auf dem sich die Luang et al beziehen. Es ist also schon ein bisschen komisch, dass sich die Forscher nicht mit der Entstehung der Embryonen beschäftigt haben.
Wie man die Verwendung dieser Embryonen jetzt findet kann jeder selbst entscheiden. Fakt ist: Die Technologie ist da. Sie wird genutzt werden, wenn nicht in Deutschland dann eben in China und anderen Ländern, in denen Embryonenforschung betrieben wird. Die Aussichten sind klar: Könnten wir bereits bei der künstlichen Befruchtung Krankheiten verhindern indem wir Gene ändern, können wir für Menschen die Träger für eine bestimmte Krankheit sind gesunden Nachwuchs erzeugen. Das System ist aber stark limitiert. Kinder nach Design zu bestellen, würde bedeuten, dass diverse Gene verändert werden müssten. Meines Erachtens lohnt sich ein solcher Eingriff also nur, wenn ein ganz bestimmtes Gen verändert werden muss. Ist mehr als ein Gen betroffen wird das alles viel schwieriger.
Fazit
Es ist nicht neu das am menschlichen Erbgut editiert wurde. Das machen die meisten Biologen tagtäglich in Zelllinien. Es ist auch nicht neu, dass bei menschlichen Zellen Gene verändert wurden. Es ist neu, dass diese Zellen Embryonen sind und die Methode CRISPR/Cas heißt. Leider ist es schändlich, dass man mit einer noch unausgereiften Technologie daran gearbeitet hat, anstatt eine schon existente, spezifischere zu verwenden. Im Vergleich ist es vielleicht weniger fragwürdig, dass nicht lebensfähige Embryonen verwendet wurden. Die ethische Debatte sollte erst einmal unaufgeregt geführt werden. Denn bis jetzt wurde nur gezeigt, dass es im Prinzip funktioniert, dass aber erwartbare Probleme aufgetreten sind. Das ist nicht überraschend. „Im Prinzip“ funktioniert so einiges. Bis zu einer genetischen Heilung von Embryonen wird noch viel Zeit vergehen. Es könnte einfacher sein, Embryonen zu selektieren, als sie künstlich zu verändern. Wenn man denn will.


Mit Genome-Editing können im Idealfall Gene selektiv in allen Zellen eines Organismus geändert werden. Man kann also aus Organismus A Organismus A’ machen, wobei A’ sich auf genau definierte Art von A unterscheidet und das bis zur letzten Körperzelle.. Aus medizinischer Sicht eröffnet das ungeahnte Möglichkeiten wie das Wegtherapieren von Erbkrankheiten – und zwar sowohl beim Ungeborenen als vielleicht sogar bei aktuell von Erbkrankheiten betroffenen Kindern oder Erwachsenen. Beispiele für schwere, das Leben verkürzende oder die Gesundheit schwer beeinträchtigende Erbrankheiten gibt es genug und die Bereitschaft ist gross, alles nur möglche zu unternehmen um diese Krankheiten zu lindern oder ihre Weitergabe auf die Nachkommenschaft zu verhindern. In Zypern beispielsweise wird von vielen werdenden Müttern die Pränataldiagnose auf Thalassämie angewandt. In Pränatale Gendiagnostik liest man dazu:
Es besteht also kein Zweifel daran, dass ein zuverlässiges Genome-Editing-Verfahren auf eine grosse Nachfrage stossen würde. Allerdings sind die Qualitätsanforderungen für den Einsatz in der Medizin sehr hoch. Vor 10 Jahren gab es nicht einmal ansatzweise eine Möglichkeit zum selektiven Genom-Editieren und jetzt gibt es mindestens die Aussicht darauf, dass das irgendwann zuverlässig funktioniert. Wenn es einmal so funktioniert, dass man es so einsetzen kann wieviele andere medizinische Therapien, wird das sehr grosse Auswirkungen haben.
CRISPR an Embryos anzuwenden war ein mediengeiles Vorpreschen. Doch CRISPR hat trotz jetzt noch fehlender Präzision bereits ein Potenzial für eine gentherapeutischen Einsatz sogar beim Menschen. Vor allem bei bestimmten genetisch bedingten Krankheiten des Blutes. Könnten beispielsweise die für Thalässamie (Sichelzellenanämie) verantwortlichen Gene in den hämatopoetischen Stammzellen (Vorläuferzellen der roten Blutkörperchen) korrigiert werden, dann wäre folgendes Vorgehen denkbar:
1) Entnahme von hämatopoetischen Stammzellen aus dem Patientenblut oder Knochenmark
2) CRISPR-Korrektur des Thalassämiegens
3) Filterung derjenigen hamätopoetischen Zellen, bei denen CRISPR funktioniert hat
4) Reinjektion, Reinfusion der erfolgreich korrigierten hämatopoetischen Zellen.
Das wäre für den Patienten risikolos, selbst wenn CRISPR noch nicht Zelle für Zelle das richtige Resultat liefert, denn man könnte die Zellen selektieren, bei denen es funktioniert hat.
Dieses Verfahren hat dann Aussicht auf Erfolg, wenn die “therapierten” Blutvorläuferzelle” sich im Patienten stärker vermehren würden als die kranken. Davon kann man aber ausgehen.
Um Erbkrankheiten zu vermeiden, muss man nicht das Erbgut manipulieren. Die meisten schweren Erbkrankheiten werden rezessiv vererbt – bei einer künstlichen Befruchtung sollte also etwa ein Viertel der Embryonen unbelastet sein. Die Selektion dieser Embryonen wird schon lange praktiziert. Das sicherer, kostengünstiger und ethisch unbedenklicher als die Manipulation der Keimbahn.
Paul Knoepfler hat das in seinem Blog schön dargestellt.
http://www.ipscell.com/2015/04/crispr-versus-pgd/
Viel Aufmerksamkeit also um so wenig Substanz. Aber die Feuilletons konnten ihre Leser wieder mit Frankenstein-Fantasien gruseln.
CRISPR/Cas9 sei nun bei Mäuseembryos fast 100% effizient berichtet NextBigFuture in einem Sammelartikel. Die bereits hohe Effizienz des Verfahrens wurde ja auch in diesem Beitrag hervorgehoben.
Damit könnten Erbrankheiten wie zystische Fibrose vor der Konzeption korrigiert oder sogar Designerbabies hergestellt werden, bei denen mehrere Gene modifziert wurden – wie das in diesem Artikel bereits angetönt wird.
Besonders interessant scheint mir der Link zu Asymmetric parental genome engineering by Cas9 during mouse meiotic exit, wo über eine ganz frühe genetische Modifikation noch vor der Konzeption berichtet wird.
Wie ich bereits im Text erwähnte ist eine Korrektur mehrerer Gene derzeit noch sehr, sehr unwahrscheinlich.